
研究背景
在营养物质匮乏的肿瘤微环境(TME)中,肿瘤细胞和CD8+T细胞会竞争性摄取有限的营养物质,最终导致CD8+T细胞功能出现障碍。已有研究表明,TME中的细胞代谢与脂肪酸氧化(FAO)有关,但在TME中CD8+T细胞的脂质代谢是如何受到调控以及如何通过脂质代谢调控CD8+T细胞的杀伤功能目前尚未阐释清晰。
研究概述
2024年3月,美国北卡罗来纳大学教堂山分校Lineberger综合癌症中心的Jessica E. Thaxton教授研究团队在Cell Metabolism杂志上发表题为“Acetyl-CoA carboxylase obstructs CD8+T cell lipid utilization in the tumor microenvironment”的研究论文,揭示了抑制TME中乙酰辅酶A羧化酶(ACC)的活性和表达可促进线粒体对游离脂肪酸的利用和生物能量的合成,从而提高CD8+T细胞在TME中的生存能力和抗癌效果。
技术路线图
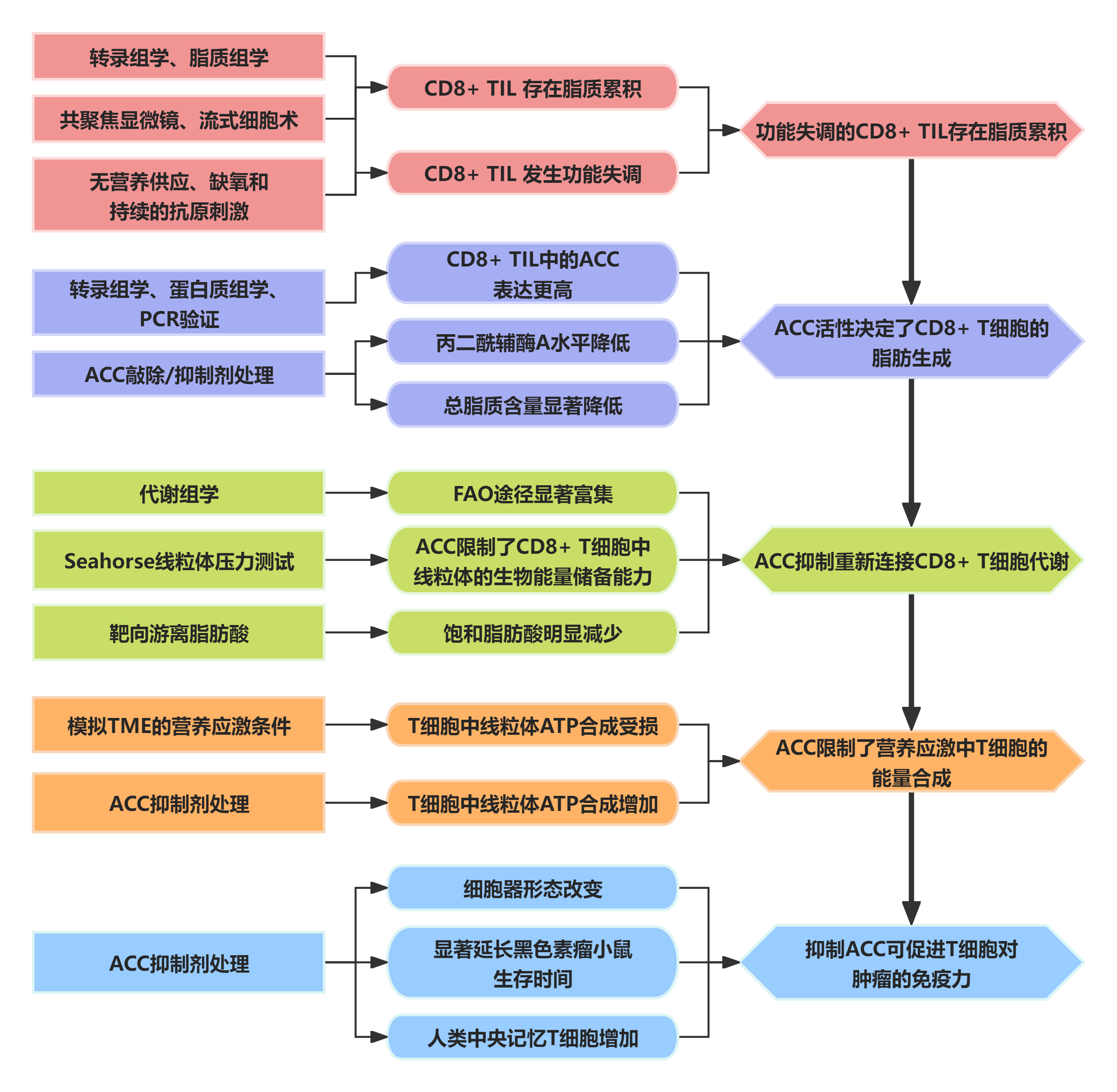
研究结果
功能失调的CD8+TIL中存在脂质累积
从纤维肉瘤中分离出的CD8+肿瘤浸润性T细胞(TILs)和自体脾脏CD8+T细胞的转录组测序和脂质组学分析结果均提示,纤维肉瘤来源的TILs中存在中性脂肪累积。共聚焦显微镜和流式细胞仪结果表明,与正常组织相比,肿瘤组织中的T细胞群中脂质积累显著,并得到了来自结肠腺癌和黑色素瘤小鼠脾脏分离的TILs样本的验证。
随后开展体外验证试验,将肿瘤细胞和T细胞分上下两个腔室共培养,与对照组相比,无营养供应、缺氧和持续的抗原刺激下的TILs中累积了更多的脂滴,且TME中TILs的功能丧失情况会随时间加剧,整体表明在TME中TILs存在脂质异常积累的现象,这与功能失调的T细胞状态有关。
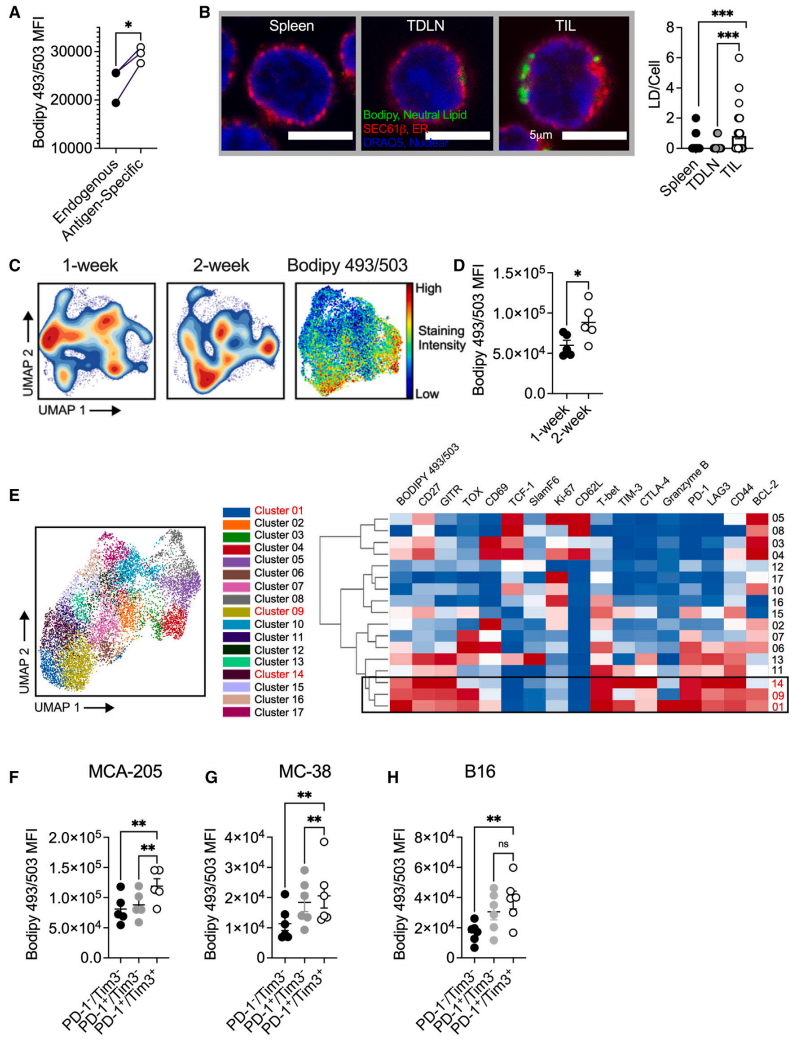
图1. 功能失调的CD8+TIL存在脂质累积
ACC决定CD8+T细胞的脂质组成
转录组学和蛋白质组学结果提示脂质合成相关蛋白ACC1的表达在CD8+TIL和脾细胞中存在显著差异,PCR结果也同样证实了CD8+TIL比外周CD8+T细胞中的ACC1表达更高,表明ACC1在TILs的脂质储存中具有关键影响。
用ND-646(ACCi,ACC1抑制剂)处理可显著降低T细胞中丙二酰辅酶A(可为脂肪酸提供2-碳单元)水平。同样,脂质组学分析发现经ACCi处理后的T细胞中总脂质含量显著降低,敲除ACC1后也观察到同样的现象,这表明ACC活性决定了CD8+T细胞的脂肪生成。

图2. ACC决定了T细胞的脂质组成
ACC抑制重新连接CD8+T细胞代谢
通过代谢组学检测分析ACCi处理和未处理的T细胞的代谢差异,共计鉴定得到69种差异代谢物,短链、中链和长链脂肪酸的线粒体β氧化是最显著富集的途径之一。与对照组相比,ACCi处理后的ATP、乙酰CoA以及TCA中间产物水平均增加,表明抑制ACC后T细胞开始依赖FAO进行能量供给。
使用Seahorse生物分析仪进行的线粒体压力测试,发现在ACC抑制条件下T细胞的备用呼吸能力(SRC,T细胞具有FAO依赖性的一个标志)加强,表明ACC限制了CD8+T细胞中线粒体的生物能量储备能力。
基于GC-MS平台的靶向游离脂肪酸分析结果提示,经ACCi处理的T细胞含有的饱和脂肪酸明显减少,单不饱和脂肪酸和多不饱和脂肪酸水平增加,表明ACCi处理后的T细胞能够更加高效地进行FAO,使细胞中脂滴减少。
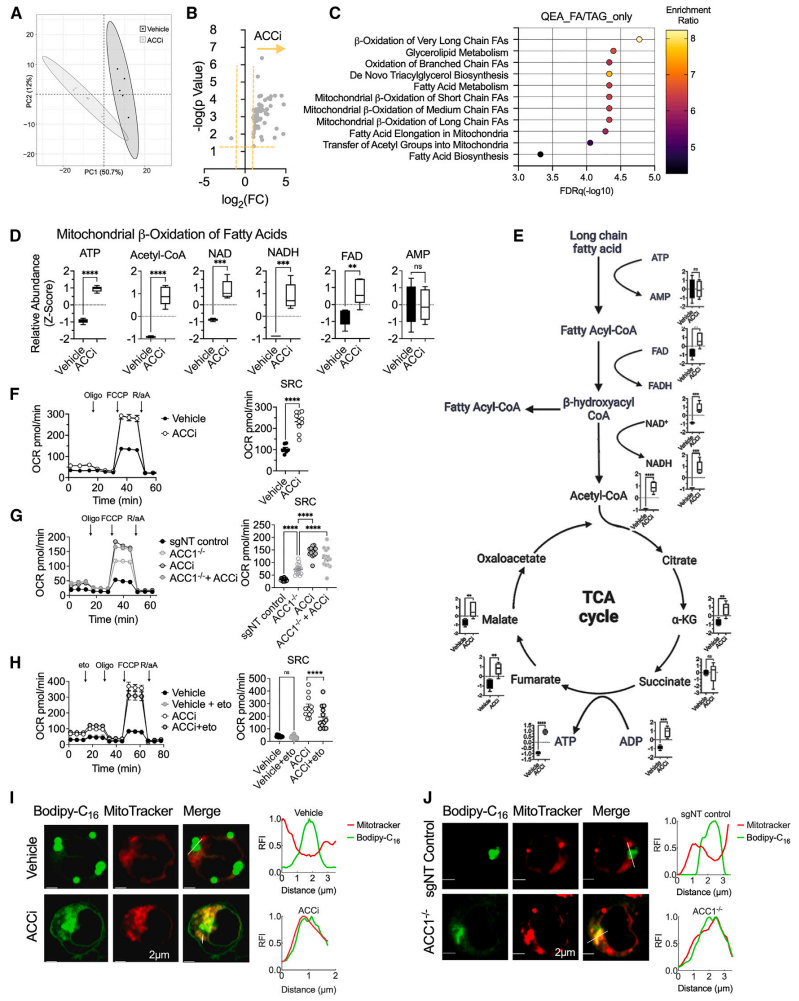
图3. ACC抑制重新连接CD8+T细胞的代谢
ACC限制了营养应激中T细胞的能量合成
通过实验模拟TME的营养应激条件发现,ACC的活性增强导致了T细胞中线粒体ATP合成受损。使用ACCi处理细胞减少ACC的活性,减少了营养胁迫中的脂滴积累,促进了线粒体FAO,并提高了ATP合成水平。这些数据表明ACC限制了营养胁迫中的T细胞生物能量学,抑制ACC有益于改善暴露于TME环境的T细胞中ATP的合成。
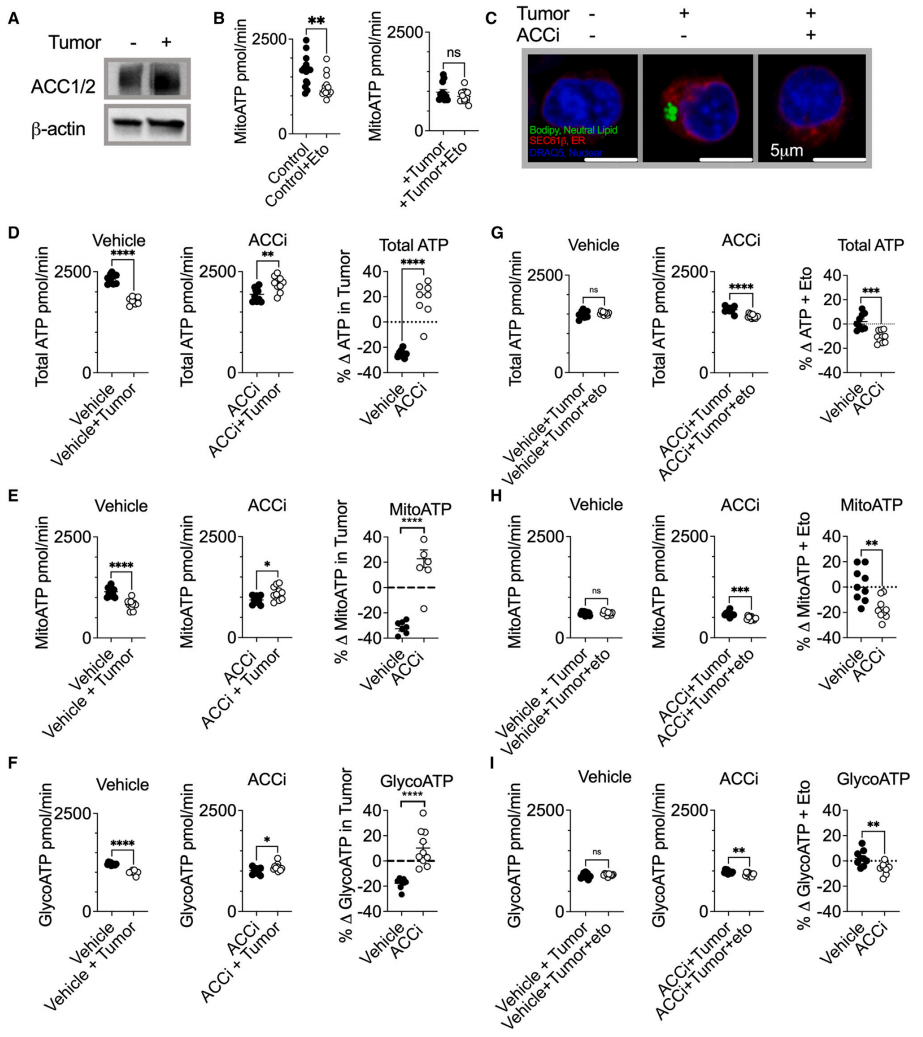
图4. ACC在营养应激下限制了T细胞的能量合成
ACCi促进T细胞对肿瘤的免疫力
转录组测序和基因集变异分析表明,ACCi处理的T细胞中与T细胞记忆和干细胞特性相关的基因表达显著增加。此外,通过流式细胞术还发现在ACCi存在下增殖的CD8+T细胞表现出大量的表型重塑。通过透射电子显微镜观察到ACC抑制促进了线粒体健康和ER-线粒体串扰,表明T细胞中的ACC活性改变了细胞器形态。
在体内实验中,ACC抑制改善了黑色素瘤小鼠T细胞肿瘤的控制,并显著延长了生存时间,使活性T细胞在肿瘤中的积累和多功能细胞因子的合成增加。进一步评估了ACCi对人类T细胞的影响,发现ACCi能够减少终末分化的效应记忆T细胞和比例,同时增加中央记忆T细胞,这表明抑制ACC进行代谢重构可以来增强人类T细胞的抗肿瘤免疫反应,是改善癌症患者细胞疗法的潜在策略。

图5. ACCi促进T细胞对肿瘤的免疫
研究结论
本研究通过联合应用代谢组学、脂质组学、蛋白质组学、转录组测序和共聚焦成像等策略,探讨了在肿瘤微环境中,肿瘤浸润性T细胞的代谢状态如何受到影响。最终发现,乙酰辅酶A羧化酶(ACC)的上调使T细胞中出现脂质积累,T细胞的代谢损伤进而影响了其抗肿瘤功能,而抑制ACC则能通过促进线粒体脂肪酸氧化、增加能量供应以增强T细胞对肿瘤的杀伤能力,表明抑制ACC的活性和表达是一种潜在的肿瘤免疫治疗策略。

参考文献
Hunt EG, Hurst KE, Riesenberg BP, et al. Acetyl-CoA carboxylase obstructs CD8+ T cell lipid utilization in the tumor microenvironment. Cell Metabolism. 2024.
请扫描二维码阅读原文

绘谱帮你测
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。
END
